Hola amigos, les traigo una pregunta.
he leído lo que he podido de teoría de lo que es las fuerzas intermoleculares sin embargo tengo confunsión cuando me colocan a reconocer la intensidad de una fuerza intermolecular y ordenarla según su punto de ebullición.
Les diré lo que se, mientras mayor sea la fuerza intermolecular en el compuesto mayor es la energía para convertirla a gas y por enede mayor es el punto de ebullición. Tengo entendido lo de ión-dipolo, dipolo-dipolo y dipolo inducido. La mayor siempre es la fuerza ión-dipolo o dipolo-dipolo sin embargo hay maneras de que el dipolo inducido la supere. ¿Cuando ocurren estos casos? De verdad que estoy muy confundido, necesito una mano.
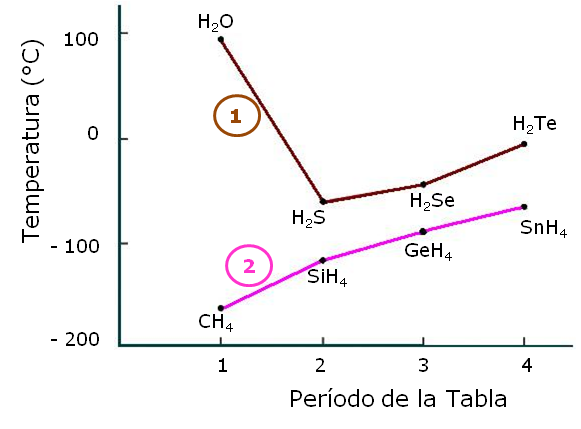
Por ejemplo ordenar, por punto de ebullición.
he leído lo que he podido de teoría de lo que es las fuerzas intermoleculares sin embargo tengo confunsión cuando me colocan a reconocer la intensidad de una fuerza intermolecular y ordenarla según su punto de ebullición.
Les diré lo que se, mientras mayor sea la fuerza intermolecular en el compuesto mayor es la energía para convertirla a gas y por enede mayor es el punto de ebullición. Tengo entendido lo de ión-dipolo, dipolo-dipolo y dipolo inducido. La mayor siempre es la fuerza ión-dipolo o dipolo-dipolo sin embargo hay maneras de que el dipolo inducido la supere. ¿Cuando ocurren estos casos? De verdad que estoy muy confundido, necesito una mano.
Por ejemplo ordenar, por punto de ebullición.









Comentario