Hola, hace mucho planteé esta misma duda y espero que todos los que me ayudaron como el caso de Richard me disculpen que siga en ello, soy incapaz de comprenderlo, he intentado hacer un acto de fe sin más, pero me consume... creo que en otras ocasiones ha sido farragoso el pateamiento de mi duda y voy a intentar una vez más, con el permiso de todos plantearlo de nuevo.
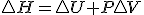
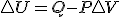
 Teniendo en cuenta estas tres relaciones termodinámicas y sustituyendo la 3º en la 2ª y esta en la primera y considerando proceso a presión constante, tenemos la siguiente expresión de la variación de entalpía:
Teniendo en cuenta estas tres relaciones termodinámicas y sustituyendo la 3º en la 2ª y esta en la primera y considerando proceso a presión constante, tenemos la siguiente expresión de la variación de entalpía: 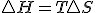 , si dicha expresión la sustituyo en la definición de energía libre
, si dicha expresión la sustituyo en la definición de energía libre 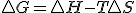 llegaríamos finalmente a que en procesos reversibles
llegaríamos finalmente a que en procesos reversibles 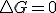 , digo en procesos reversibles, pues al poner el calor dependiendo de la entropía he usado precisamente la definición de entropía para procesos reversibles. En este desarrollo, vemos que se ha supuesto que en el proceso existe únicamente un trabajo de expansión..
, digo en procesos reversibles, pues al poner el calor dependiendo de la entropía he usado precisamente la definición de entropía para procesos reversibles. En este desarrollo, vemos que se ha supuesto que en el proceso existe únicamente un trabajo de expansión..
Ahora, el segundo principio de termodinámica, nos indica el criterio de espontaneidad: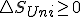 mayor en proceso irreversibles e igual en procesos reversibles, vamos ahora a relacionar esto con la energía libre de Gibbs para que sea esa función de estado la que nos sirva como criterio de espontaneidad en las reacciones químicas:
mayor en proceso irreversibles e igual en procesos reversibles, vamos ahora a relacionar esto con la energía libre de Gibbs para que sea esa función de estado la que nos sirva como criterio de espontaneidad en las reacciones químicas: 
Hemos visto anteriormente en el desarrollo de formulas termodinámicas, que a presión constante y existiendo solo trabajo de expansión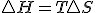 y por tanto en
y por tanto en 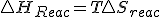 y
y  y como en la reacción, podemos decir que
y como en la reacción, podemos decir que 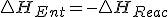 , entonces puedo decir que
, entonces puedo decir que  y sustituyendo en la expresión de la energía libre de Gibbs obtengo :
y sustituyendo en la expresión de la energía libre de Gibbs obtengo :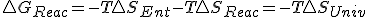 y de aquí y en base al 2º principio en las reacciones químicas a presión constante y solo con trabajo de expansión para que
y de aquí y en base al 2º principio en las reacciones químicas a presión constante y solo con trabajo de expansión para que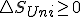 mayor en irreversibles e igual en reversibles entonces,
mayor en irreversibles e igual en reversibles entonces,  , es decir igual a cero en procesos reversibles y menor que cero en los irreversibles, y se acaba diciendo igual a cero en el equilibrio de la reacción´pon y menor que cero en los espontáneos.
, es decir igual a cero en procesos reversibles y menor que cero en los irreversibles, y se acaba diciendo igual a cero en el equilibrio de la reacción´pon y menor que cero en los espontáneos.
Hasta aquí todo claro, pero esa condición de trabajo que solo exista trabajo de expansión es la que me está volviendo loca..... si consideramos todo el desarrollo termodinámico anterior, pero tenemos en cuenta en esta ocasión, la existencia de un trabajo útil además del trabajo de expansión, por ejemplo trabajo eléctrico en una reacción redox, la expresión de la energía interna será esta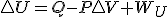 en lugar de la usada en el otro desarrollo y llegaremos al final a que
en lugar de la usada en el otro desarrollo y llegaremos al final a que 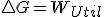 en procesos reversibles, y como antes, digo en procesos reversibles , pues en el desarrollo al poner el calor dependiendo de la entropía he usado precisamente la definición de entropía para procesos reversibles.
en procesos reversibles, y como antes, digo en procesos reversibles , pues en el desarrollo al poner el calor dependiendo de la entropía he usado precisamente la definición de entropía para procesos reversibles.
Si considerando el trabajo útil, tratamos como antes de vincular con
con 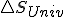 que es quien realmente determina el criterio de espontaneidad según el segundo principio, nos quedaría:
que es quien realmente determina el criterio de espontaneidad según el segundo principio, nos quedaría: 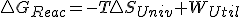 y que en un proceso reversible, como sabemos que
y que en un proceso reversible, como sabemos que 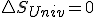 llegaríamos a la expresión que vimos antes
llegaríamos a la expresión que vimos antes 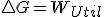 pero si la entalpia del universo es mayor que cero es decir proceso espontaneo, no queda muy claro como ha de ser en ese caso la variación de la energía libre, por esto, entiendo que en los libros cuando vinculan la espontaneidad con la energía libre dicen que para procesos en los que no haya trabajo útil pues vemos que si lo hay el criterio de espontaneidad en base a Gibbs no es tan claro.
pero si la entalpia del universo es mayor que cero es decir proceso espontaneo, no queda muy claro como ha de ser en ese caso la variación de la energía libre, por esto, entiendo que en los libros cuando vinculan la espontaneidad con la energía libre dicen que para procesos en los que no haya trabajo útil pues vemos que si lo hay el criterio de espontaneidad en base a Gibbs no es tan claro.
Yo hasta aquí, que creo que los desarrollos de las formulas son correctos, tendría claro eso, que el criterio de espontaneidad en base a Gibbs es para reacciones sin trabajo útil.
El problema llega cuando analizamos una reacción redox, en ese caso hay trabajo útil, y sin embargo se considera igual en el equilibrio, menor en procesos espontáneos, que es precisamente lo que se obtenía en el primer planteamiento, sin trabajo útil.
igual en el equilibrio, menor en procesos espontáneos, que es precisamente lo que se obtenía en el primer planteamiento, sin trabajo útil.
Si se aplicase el desarrollo en el que existe trabajo útil, como es el caso, en el equilibrio de la reacción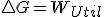 y no igual
y no igual
Espero algún comentario
Gracias,
Ahora, el segundo principio de termodinámica, nos indica el criterio de espontaneidad:
Hemos visto anteriormente en el desarrollo de formulas termodinámicas, que a presión constante y existiendo solo trabajo de expansión
Hasta aquí todo claro, pero esa condición de trabajo que solo exista trabajo de expansión es la que me está volviendo loca..... si consideramos todo el desarrollo termodinámico anterior, pero tenemos en cuenta en esta ocasión, la existencia de un trabajo útil además del trabajo de expansión, por ejemplo trabajo eléctrico en una reacción redox, la expresión de la energía interna será esta
Si considerando el trabajo útil, tratamos como antes de vincular
Yo hasta aquí, que creo que los desarrollos de las formulas son correctos, tendría claro eso, que el criterio de espontaneidad en base a Gibbs es para reacciones sin trabajo útil.
El problema llega cuando analizamos una reacción redox, en ese caso hay trabajo útil, y sin embargo se considera
Si se aplicase el desarrollo en el que existe trabajo útil, como es el caso, en el equilibrio de la reacción
Espero algún comentario
Gracias,










Comentario