Hola a todos. Estos días, tras estudiar por mi cuenta física y terminar el tema de termodinámica e comenzado a realizar ejercicios y me encuentro que algo se me escapa. Me gustaría exponer el ejercicio (no para que me lo solucionen sino para aclarar conceptos)
Un mol de un gas mono atómico esta a una temperatura de 273 º K esta a presión de 1 atmósfera.
1º) Este gas se expande de forma adiabática (no intercambia calor) hasta otro estado con el doble de volumen,
Considerar que R = 0,82 y ʎ = 1,66.
Tenemos la temperatura inicial, la cantidad de sustancia inicial y la presión inicial. Por lo tanto podemos encontrar el volumen inicial. Así tendremos la posición inicial en el sistema coordenadas presión volumen.
Calculamos las coordenadas finales tras el proceso adiabático. Tenemos el volumen inicial y la presión inicial. Con estos datos podemos encontrar la presión final puesto que el volumen se dobla. Después podremos encontrar la temperatura final.
El problema surge cuando compruebo la relación entre todas estas las características con la ecuación general de los gases “P·V=n·R·T”. Es decir la relación de los gases no se cumple. “0,3164·152,88 ≠ 1·0,82·180,1124” Y eso es lo que no entiendo.
¿En cualquier punto de la evolución (punto de equilibrio) de un gas no se debería cumplir siempre esa relación?.
Y si no es así,
¿cuando se cumple y cuando no? Espero que no sea un error matemático mio que no pueda ver y no os este molestando por nada. Un saludo.





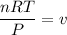
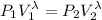
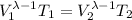
Comentario