Hola amigos. Aquí voy otra vez con una duda. En un hilo anterior plantee algunas dudas sobre el concepto de entropía y gracias a las respuestas de varios amigos del foro comprendí, entre otras cosas, que para calcular la variación de entropía en un proceso debería considerarse siempre una trayectoria reversible que conecte el estado inicial con el estado final, aún cuando el proceso real no sea reversible, es decir, se debe usar una trayectoria ficticia que sea reversible. Mis dudas ahora son las siguientes:
1. Si la entropía es una función de estado, es decir, independiente de la trayectoria del proceso, ¿por qué es indispensable calcular su variación usando una trayectoria reversible y no una irreversible?
2. ¿Cómo distinguir concretamente una trayectoria reversible de una trayectoria irreversible?
Como siempre, muchas gracias por sus respuestas.
1. Si la entropía es una función de estado, es decir, independiente de la trayectoria del proceso, ¿por qué es indispensable calcular su variación usando una trayectoria reversible y no una irreversible?
2. ¿Cómo distinguir concretamente una trayectoria reversible de una trayectoria irreversible?
Como siempre, muchas gracias por sus respuestas.








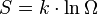

Comentario