Buenos Días.
Tengo una duda sobre la entropía que no sé responder.
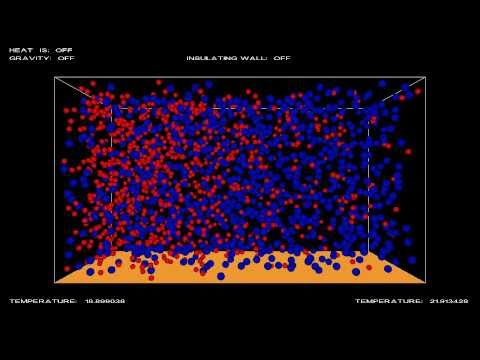
Una de las ideas con las que nos quedamos los profanos al leer sobre la entropía, es que el aumento del desorden tiene que ver con las probabilidades de los subsistemas posibles. Si tiramos las páginas sueltas de El Quijote al aire, es más fácil que caigan desordenadas que ordenas, porque hay muchas más combinaciones posibles de páginas desordenadas que de páginas ordenadas.
Igual sucedería si en un recipiente cualquiera tengo dos líquidos o gases distintos separados de alguna manera y anulo el mecanismo que los separa: terminarían mezclándose.
Se dice que teóricamente sería posible que volvieran a su ubicación original: el primero de los gases/líquidos en un lado y el segundo en el otro lado, pero que sería muy improbable, porque las posibilidades de combinación las moléculas desordenadas son mucho mayores que las combinaciones con las moléculas ordenadas.
Supongamos que tengo un recipiente cerrado de 1 metro cúbico con un gas a 1 atmósfera de presión. Introduzco otro recipiente que contiene otro gas a 1,5 atmósferas tapado con un tapón que se descompone en 1 hora.
Se abre segundo recipiente y el gas que hay en el interior ex expulsado hacia afuera por la presión y termina mezclándose con el gas del recipiente inicial.
Pues resulta que a partir de ahí, la probabilidad de volver a la situación inicial no es muy baja. Es nula. No habría manera de volver a introducir todas las moléculas del gas del segundo recipiente dentro, porque iría aumentando la presión y las expulsaría.
No parece que esto concuerde con lo descrito inicialmente. ¿Por qué?
Tengo una duda sobre la entropía que no sé responder.
Una de las ideas con las que nos quedamos los profanos al leer sobre la entropía, es que el aumento del desorden tiene que ver con las probabilidades de los subsistemas posibles. Si tiramos las páginas sueltas de El Quijote al aire, es más fácil que caigan desordenadas que ordenas, porque hay muchas más combinaciones posibles de páginas desordenadas que de páginas ordenadas.
Igual sucedería si en un recipiente cualquiera tengo dos líquidos o gases distintos separados de alguna manera y anulo el mecanismo que los separa: terminarían mezclándose.
Se dice que teóricamente sería posible que volvieran a su ubicación original: el primero de los gases/líquidos en un lado y el segundo en el otro lado, pero que sería muy improbable, porque las posibilidades de combinación las moléculas desordenadas son mucho mayores que las combinaciones con las moléculas ordenadas.
Supongamos que tengo un recipiente cerrado de 1 metro cúbico con un gas a 1 atmósfera de presión. Introduzco otro recipiente que contiene otro gas a 1,5 atmósferas tapado con un tapón que se descompone en 1 hora.
Se abre segundo recipiente y el gas que hay en el interior ex expulsado hacia afuera por la presión y termina mezclándose con el gas del recipiente inicial.
Pues resulta que a partir de ahí, la probabilidad de volver a la situación inicial no es muy baja. Es nula. No habría manera de volver a introducir todas las moléculas del gas del segundo recipiente dentro, porque iría aumentando la presión y las expulsaría.
No parece que esto concuerde con lo descrito inicialmente. ¿Por qué?













Comentario